治験事務局(治験審査委員会)
- トップページ
- 診療科・部門
- 治験事務局(治験審査委員会)
- 治験依頼者の方へ
- 各診療科の疾患別診療実績
- 治験実施までの流れ
- (IRB)開催日程と申請締切日について
- DDworks Trial Siteの使用について
- 治験費用の算定について
- 治験依頼者からよくあるご質問(Q&A)
各診療科の疾患別診療実績
治験依頼者の方へ
2024年5月1日現在、下記の診療科では、次の疾患領域・分野における治験を実施することが可能です。
なお下記以外の診療科・疾患領域についても治験の受け入れ・実施が可能な場合がございますので、治験事務局までお問い合わせください。
| 2023年度症例数 | ||
| 診療科 | 治療内容(疾患名など) | 症例数 |
|---|---|---|
| 総合内科・感染症内科 | 感染症全般 | – |
| 血液内科 | 悪性リンパ腫 | 10 |
| 骨髄異形成症候群 | 5 | |
| 多発性骨髄腫 | 3 | |
| 急性骨髄性白血病 | 2 | |
| 慢性骨髄性白血病 | 2 | |
| 骨髄増殖性腫瘍 | 2 | |
| 特発性血小板減少性紫斑病 | 2 | |
| 急性リンパ性白血病 | 1 | |
| 後天性血友病 | 1 | |
| 糖尿病内分泌代謝内科 | 甲状腺疾患 | 50 |
| 糖尿病 | 30 | |
| 糖尿病性腎症 | 10 | |
| 下垂体疾患 | 3 | |
| 副腎疾患 | 3 | |
| 循環器内科 | PCI(経皮的冠動脈インターベンション) | 399 |
| EVT(下肢動脈インターベンション) | 55 | |
| ICD、CRT、Pacemaker留置 | 96 | |
| CAG心臓カテーテル検査 | 862 | |
| Abl不整脈に対するアブレーション | 184 | |
| 泌尿器科 | 尿路感染症に対する抗菌化学療法 | 10 |
| 下部尿路閉塞関連 | 10 | |
| 結石関連 | 10 | |
| 去勢抵抗性前立腺癌に対する薬物療法 | 5 | |
| 尿路上皮癌に対する化学療法 | 5 | |
| 尿路上皮癌に対する薬物療法 | 5 | |
| 耳鼻咽喉科 | 中耳炎 (慢性中耳炎・滲出性中耳炎・真珠性中耳炎等含む) |
169 |
| アレルギー性鼻炎 | 272 | |
| 小児アレルギー性鼻炎 | 22 | |
| 副鼻腔炎(急性・慢性副鼻腔炎) | 236 | |
| 好酸球数副鼻腔炎 | 70 | |
| 鼻茸 | 8 | |
| 耳鳴り | 32 | |
| ※症例数はレセプト病名より算出。詳細な症例数については選定時にご確認ください。 | ||
| 外科 | 大腸癌 | 99 |
| 胃癌(胃切除症例) | 59 | |
| 直腸癌 | 55 | |
| 転移性肝癌 | 11 | |
| 胆道癌 | 10 | |
| 膵癌 | 9 | |
| 食道癌 | 8 | |
| 肝癌 | 5 | |
| 心臓血管外科 | 弁膜症手術 | 86 |
| 腹部大動脈瘤手術 | 29 | |
| 冠動脈バイパス術 | 26 | |
| 心房細動手術 | 22 | |
| 胸部大動脈瘤手術 | 20 | |
| 救命診療科 | 敗血症 | 10 |
| 頭部外傷 | 5 | |
| 体幹部外傷(胸部・腹部・骨盤など) | 3 | |
| 汎発性腹膜炎(下部消化管穿孔など) | 3 | |
| 心停止 | 3 | |
治験実施までの流れ
新規治験の流れは以下の通りです。
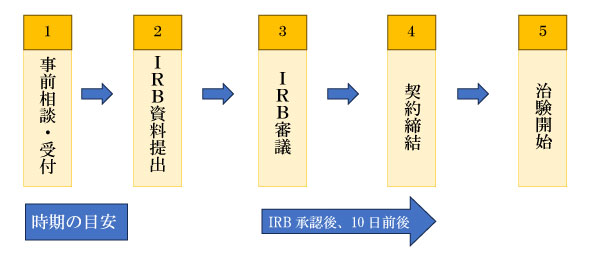
①事前相談・受付
治験に関する相談・依頼は下記までお問い合わせください。
TEL:072-469-3111(代表)
メール: j-chikenあrgmc.izumisano.osaka.jp (治験事務局)
(「あ」のところを@に変更してお送りください)
時間:月~金(9:00~17:00)(土日祝は除く)
②IRB資料提出
各月に設定された提出期限までに、申請書類を提出いただきます。
※原則、申請書類の提出締切日は毎月第1金曜日17:00迄。
※「院内書式」が必要な場合は、治験事務局までお申し出ください。
③IRB審議
治験事務局より審議の結果を連絡いたします。
下記のIRB開催日程をご確認ください。
④契約締結
・「治験契約書」や各種「覚書」の締結を進めます。
・下記から契約締結時に必要な書類をご確認ください。
契約・契約締結後提出書類一覧(PDF)
⑤治験開始
(IRB)開催日程と申請締切日について
- 原則第4金曜日に開催予定。
※審査がない場合は開催いたしません。開催月
IRB開催日
提出書類締め切り
2024年10月
2024年10月25日(金)
10月4日(金)
2024年11月
2024年11月22日(金)
11月1日(金)
2024年12月
2024年12月27日(金)
12月6日(金)
2025年1月
2025年1月24日(金)
1月6日(月)
2025年2月
2025年2月28日(金)
2月7日(金)
2025年3月
2025年3月28日(金)
3月7日(金)
2025年4月
2025年4月25日(金)
4月4日(金)
2025年5月
2025年5月23日(金)
5月2日(金)
2025年6月
2025年6月27日(金)
6月6日(金)
2025年7月
2025年7月25日(金)
7月4日(金)
2025年8月
2025年8月22日(金)
8月1日(金)
2025年9月
2025年9月26日(金)
9月5日(金)
- 原則、申請書類の提出締切日は毎月第1金曜日17:00迄。
- 院内書式は治験事務局までお問い合わせください。
DDworks Trial Siteの使用について
当院では、治験関連文書を原則電子保管とすることを目的として、「DDworks Trial Site」を導入しました。
2024年8月IRBに提出する資料より、治験関連文書の電磁的授受・保管を実施します。
「DDworks Trial Site」に関するご質問、ご相談は当院治験事務局までお問い合わせください。
DDworks Trial Siteの使用について
- DDworks Trial Site依頼者向け説明資料
・当院からのお願い
・SDV・監査時の操作手順
・治験関連文書を電磁的記録として取扱い確認すべきチェックリスト
- 初回ログイン時説明資料
・ユーザーズガイド
・かんたんセットアップガイド
- 治験の申請に係る手続きについて
・システム化業務フロー
・DDworks Trial Site 申請マニュアル
・版数入力のルール
- アカウント発行申請
・アカウント発行申請書
・アカウント発行申請書(モニタリング・監査担当者用)
※IRB申請、必須文書閲覧を行う方等、必要な方を登録してください。
※アカウントが発行されましたら、e-learningの受講をお願いします。
- アカウント申請先
| アカウント 申請先 |
りんくう総合医療センター・先進医療開発センター(治験事務局)宛 メール: j-chikenあrgmc.izumisano.osaka.jp (治験事務局) (「あ」のところを@に変更してお送りください) 時間:月~金(9:00~17:00)(土日祝は除く) |
|---|
治験に係るシステム利用料の導入について
治験費用の算定について
- 治験費用算定要領(PDF)(令和6年4月1日変更)
- 治験費用算定要領 解説表
- 臨床試験研究経費ポイント算出表(治験)(PDF) (令和5年11月1日改定)
- 臨床試験研究経費ポイント算出表(製造販売後)(PDF) (令和5年11月1日改定)
- 治験薬管理ポイント表(PDF) (令和5年11月1日新規)
- 治験薬管理ポイント表解説(PDF)
治験費用改定について
令和5年11月1日以降、新たに契約締結する治験より治験費用を改定いたします。
※なお改訂した新たな基準は、2023年11月1日より新規に契約締結する治験を対象といたしますので、それ以前に契約済みの治験は対象ではありません。
また何かご不明な点がございましたら、当院治験事務局までお問い合わせください。
| 治験に関する お問い合わせ |
りんくう総合医療センター 研修棟 3階 治験事務局 電話: 072ー469-3111(代表) e-mail: j-chikenあrgmc.izumisano.osaka.jp (「あ」のところを@に変更してお送りください) 平日:月~金9:00~17:00(祝日を除く) |
|---|
- 診療科・部門
- 総合内科・感染症内科
- 糖尿病・内分泌代謝内科
- 腎臓内科
- 血液内科
- 肺腫瘍内科
- 脳神経内科
- 循環器内科
- 呼吸器内科
- 消化器内科
- 乳腺内分泌外科
- 消化器外科
- 脳神経外科
- 心臓血管外科
- 整形外科
- 形成外科
- 呼吸器外科
- 小児科
- 産婦人科
- 泌尿器科
- 眼科
- 耳鼻咽喉科・頭頸部外科
- 口腔外科
- 放射線科
- 麻酔科
- リハビリテーション科
- 救急科
- 救命診療科
- 国際センター
- 健康管理センター(人間ドック・健康診断)
- 診療支援局について
- 薬剤部門
- 検査・栄養部門
- 検査部門
- 臨床検査
- 病理検査
- 放射線部門
- 臨床工学・技術部門
- 臨床工学
- 臨床技術
- 感染症センター
- 手術センター
- 心臓・血管センター
- 泉州広域母子医療センター
- 後期研修内容の詳細
- 急性期外科センター
- 高度脳損傷・脳卒中センター
- リハビリテーションセンター
- がん治療センター
- 甲状腺センター
- 糖尿病センター
- 血液浄化センター
- 放射線治療センター
- 聴覚・言語支援センター
- 栄養管理センター
- 機能外傷センター
- ドクターサポートセンター
- 人工関節センター
- 先進医療開発センター(臨床研究・治験・RICWA)
- 臨床研究
- 治験事務局(治験審査委員会)
- 患者サポートセンター
- RICWA(りんくうウェルネスケア研究センター)
- 臨床研修センター
- りんくう総合医療センター看護局
- がん相談支援センター
- 医療相談窓口